Die Funktion flüchtiger Signalstoffe bei der Verteidigung von Pflanzen gegen Schädlinge
Forschungsbericht (importiert) 2006 - Max-Planck-Institut für chemische Ökologie
Pflanzen können sich durch die Abgabe von Duftstoffen verteidigen
Pflanzen sind standortgebunden und müssen sich deswegen gegenüber Fraßfeinden ihrer jeweiligen Umwelt verteidigen. Viele der pflanzlichen Verteidigungsmechanismen beruhen auf der Bildung von speziellen Substanzen, die pflanzliche Naturstoffe oder Sekundärmetabolite genannt werden. Viele dieser Naturstoffe wirken direkt als Toxine oder Fraßhemmstoffe auf den Fraßfeind und verringern damit den Schaden an der Pflanze [1]. So bilden zum Beispiel Nadelbäume Baumharze, die Fraßfeinde wie Borkenkäfer abwehren und gleichzeitig die von den Insekten verursachten Verletzungen verschließen. Ebenso bilden Tabakpflanzen nach Befall mit Raupen Nikotin, das für die meisten Insekten giftig ist.
Die Abgabe von flüchtigen Pflanzenstoffen konnte erst in den letzten zwei Jahrzehnten untersucht werden, nachdem empfindliche Methoden zur Sammlung und Analyse dieser Duftstoffe entwickelt wurden. Viele Pflanzen geben nach der Verletzung durch pflanzenfressende Insekten (Herbivoren) eine komplexe Mischung von Duftstoffen ab, die aus über hundert verschiedenen Substanzen bestehen kann. Die Duftstoffe scheinen nicht der direkten Abwehr der Herbivoren zu dienen, sondern können in einigen Fällen die natürlichen Feinde der Herbivoren anlocken. Diese natürlichen Feinde, die im Pflanzenbau auch Nützlinge genannt werden, verringern den Fraßschaden an der Pflanze und tragen damit zur Verteidigung der Pflanze bei. Die so genannte „indirekte Verteidigung“ wurde erst in wenigen Pflanzen nachgewiesen, darunter Tabak, Limabohne, Nadelbäume und Mais.
Für Mais wurden bereits zwei indirekte Verteidigungsmechanismen beschrieben, die durch einen Angriff der Blätter oder der Wurzeln durch zwei verschiedene Fraßfeinde ausgelöst werden können. Ein Angriff von Raupen des Nachtschmetterlings Spodoptera littoralis führt zur Bildung eines komplexen Gemisches von Duftstoffen in den Blättern der Maispflanze [2]. Mithilfe absorbierender Materialien können diese Duftstoffe aus dem die Pflanze umgebenden Luftraum (headspace) gesammelt werden. Das Duftstoffgemisch wird anschließend mit einem Gaschromatographen aufgetrennt und die Komponenten werden nachfolgend mittels Massenspektrometrie analysiert (Abb. 1A) Die Duftstoffe der Blätter enthalten überwiegend Substanzen aus Stoffklassen der Terpene sowie Indol und aromatische Substanzen. Parasitische Wespen nutzen dieses Duftstoffgemisch, um die Schmetterlingsraupe zu finden (Abb. 1B). Sobald die Larven der Wespe innerhalb der Raupe heranwachsen, frisst die Raupe weniger und stirbt [3]. Das ist zum Vorteil der Pflanze, die dadurch weniger Schaden erleidet.
Eine ähnliche indirekte Verteidigung wurde gegenüber dem Westlichen Maiswurzelbohrer (Diabrotica virgifera) beobachtet [4]. Sobald dessen Larven an den Wurzeln der Pflanze fressen, produziert sie die Substanz (E)-β-Caryophyllen, ein Sesquiterpen (Abb. 1C). Das (E)-β-Caryophyllen diffundiert durch den Boden und lockt insektenfressende Nematoden zu den befallenen Wurzeln (Abb. 1D). Erste Feldexperimente zeigten, dass das (E)-β-Caryophyllen-Signal der Wurzel die Schädigung der gesamten Pflanze durch den westlichen Maiswurzelbohrer verringern und so Ertragseinbußen vorbeugen kann.

Eine interessante und wichtige Aufgabe der chemischen Ökologie ist die genaue Charakterisierung dieser indirekten Verteidigungsreaktionen zwischen Pflanze, Herbivoren und Feind der Herbivoren. Dabei wird vor allem untersucht, welche Substanzen innerhalb des komplexen Duftstoffgemisches die wichtigen Signale dieser Verteidigungsreaktion darstellen, wie diese Signalsubstanzen von der Pflanze gebildet werden und wie wichtig die indirekte Verteidigung für das Überleben einer Pflanze in ihrem Biotop ist.
Pflanzen bilden komplexe Duftstoffgemische durch Multiprodukt-Enzyme
Die Duftstoffgemische der Pflanzen bestehen überwiegend aus Terpenen, die eine große strukturelle Vielfalt besitzen und mit über 30.000 Substanzen die größte Gruppe pflanzlicher Naturstoffe bilden [5]. Das gemeinsame strukturelle Merkmal aller Terpene ist ihre Biosynthese aus Isoprenoid-Einheiten bestehend aus fünf Kohlenstoffatomen. Durch Prenylphosphat-Synthasen können diese Einheiten zu größeren Molekülen verbunden werden. Aus der Kondensation von zwei oder drei Isopreneinheiten entstehen Geranyldiphosphat (GPP) oder Farnesyldiphosphat (FPP) mit jeweils 10 bzw. 15 Kohlenstoffatomen. In einem folgenden Syntheseschritt werden aus den Ausgangsprodukten GPP bzw. FPP nach einer Reihe von Zyklisierungen und Umlagerungen die grundlegenden Kohlenstoffgerüste der Terpene gebildet. Diese Reaktion wird von Terpensynthasen katalysiert und ist der erste, irreversible Schritt zur Bildung komplexer Terpengemische.
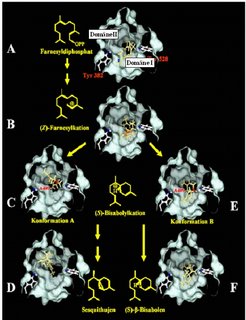
Vor allem die Enzymklasse der Terpensynthasen, die als Multiprodukt-Enzyme aus einem Substrat mehrere Produkte formen können, ist verantwortlich für die hohe Diversität pflanzlicher Terpene. Um diesen einzigartigen Multiprodukt-Mechanismus zu verstehen, wurde der Reaktionsmechanismus einer Terpensynthase aus Mais, TPS4, genau untersucht [6,7]. Dazu wurde die Proteinstruktur von TPS4 modelliert und anhand dieser Modelle die Oberfläche des aktiven Zentrums, in dem die Reaktion stattfindet, konstruiert [7]. In das aktive Zentrum wurden räumliche Modelle des Substrates, der Intermediate und der Produkte eingepasst (Abb. 2). Das Substrat Farnesyldiphosphat bindet mit seiner Diphosphatgruppe an einen Aspartat-Magnesium-Komplex am Eingang des aktiven Zentrums und ragt mit dem hydrophoben Teil in das katalytische Zentrum. Nach der Dephosphorylierung entsteht das trans-Nerolidyl-Carbokation, das sich zum cis-Isomer umlagert und dadurch eine 1-6 Zyklisierung des Carbokations ermöglicht. Das entstehende Bisabolyl-Carbokation kann in mehreren Positionen innerhalb des aktiven Zentrums vorliegen und so vermutlich den Ausgang der Reaktion beeinflussen.
Um die Grundlagen der Produktspezifität von Terpensynthasen zu verstehen, wurden spezifische Aminosäuren in den Domänen I and II ausgetauscht [7]. Die mutagenisierten Enzyme wurden in einem bakteriellen System exprimiert und deren enzymatische Aktivität mit der des unveränderten Enzyms verglichen. Durch die Blockierung der Domäne I konnte das (E,E)-FPP Substrat nicht mehr genutzt werden. Das artifizielle Substrat (Z,E)-FPP konnte dagegen von diesen Mutanten zu (S)-β-Bisabolen und Sesquithujen umgewandelt werden. Die Domäne I ist daher für die ersten Schritte der enzymatischen Reaktion bis zur Isomerisierung des Substrates unbedingt notwendig. Im Gegensatz dazu eliminieren Mutationen in Domäne II die Bildung von bizyklischen Reaktionsprodukten aus (E,E)-FPP und (Z,E)-FPP, was auf eine Funktion der Domäne II bei der zweiten Zyklisierung hindeutet. Die Konformationsänderung des (S)-Bisabolyl-Carbokation-Intermediates zwischen beiden Domänen ermöglicht daher die Bildung von multiplen Terpenen mit hoher struktureller Diversität, die Bestandteile des komplexen Duftstoffgemisches der Maispflanze sind.
Welche Duftstoffe sind für die Verteidigung der Pflanze wichtig?
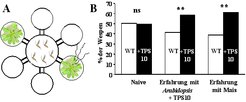
Da die von der Pflanze abgegebenen Duftstoffgemische sehr komplex sind, ist die Bestimmung der funktionell wichtigen Komponenten innerhalb des Gemisches nicht einfach. Es ist möglich, dass entweder einzelne Substanzen oder auch bestimmte Kombinationen der Duftstoffe für die Anlockung des Nützlings verantwortlich sind. Nach Herbivorenbefall von Mais wird die Terpensynthase TPS10 aktiviert, die einen großen Teil der flüchtigen Terpene bildet [8]. Um herauszufinden, ob diese Terpene eine wichtige Rolle beim Anlocken der parasitischen Wespen spielen, wurde das Gen der Terpensynthase TPS10 in Pflanzen der Spezies Arabidopsis thaliana transformiert, die diese Stoffe natürlicherweise nicht bilden kann. Die gentechnisch veränderten Pflanzen können nun benutzt werden, um die Attraktivität der Mais-Duftstoffe auf parasitische Wespen zu untersuchen. Das geschieht in einem Olfaktometer, in dem die Wespe zwischen dem Duft von transformierten und Kontrollpflanzen wählen kann (Abb. 3). Nach einer ersten Assoziation zwischen Duftstoff und Eiablage nutzt die parasitische Wespe Cotesia marginiventris tatsächlich die Duftstoffe von TPS10, um die Raupe zu finden.
Die chemische Natur des unterirdischen Signals von Wurzelbohrer-geschädigten Pflanzen war leichter zu ermitteln (Abb.4A). Eine Extraktion der Wurzelinhaltsstoffe zeigte eine hohe Konzentration von (E)-β-Caryophyllen in Wurzelbohrer-geschädigten Maiswurzeln, die nicht in den Wurzeln von Kontrollpflanzen auftrat (Abb.4B). Da (E)-β-Caryophyllen im Gegensatz zu den Produkten der Terpensynthase TPS10 synthetisch erhältlich ist, konnte die Attraktivität gegenüber insektenpathogenen Nematoden direkt untersucht werden [4].

Die Feinde meiner Feinde sind meine Freunde - ein agronomisch nutzbares Konzept?
Die Nutzung der indirekten Verteidigung von Pflanzen ist ein attraktives Konzept, um die Resistenz von Pflanzen gegenüber Herbivoren zu erhöhen und weniger Pestizide ausbringen zu müssen [9]. Die wichtigste Voraussetzung dafür ist allerdings eine genaue Kenntnis der Interaktionen zwischen Pflanze, Herbivore und deren Feinden, um sie auf eine Feldsituation übertragen zu können. Ebenso muss sichergestellt werden, dass die Feinde der Herbivoren auf dem Feld in großer Zahl auftreten und dass die Duftsignale keine weiteren schädigenden Herbivoren anlocken.
Die indirekte Verteidigung der Pflanze muss auch in heutige, konventionelle Strategien des Pflanzenschutzes integriert werden. So dürfen Pestizide zum Beispiel nicht den Feinden der Herbivoren schaden und auch nicht im Körper der Herbivoren zu Konzentrationen akkumulieren, die für ihre Angreifer toxisch sind. Auch wenn unser Verständnis der indirekten Verteidigung der Pflanze in den letzten Jahren sehr gewachsen ist, ist die ökologische und biochemische Untersuchung dieser Interaktionen noch nicht weit genug fortgeschritten, um das Potenzial von neuen Strategien im Bereich des Pflanzenschutzes abschätzen zu können.

![Die multiplen Produkte der Terpensynthase TPS4 aus Mais werden durch zwei katalytische Domänen mit unterschiedlicher Aktivität im aktiven Zentrum des Enzyms gebildet. Das Substrat Farnesyldiphosphat (A) wird im aktiven Zentrum von TPS4 dephosphoryliert und zum cis-Carbokation isomerisiert (B). Durch C1-C6-Zyklisierung entsteht das Bisabolyl-Carbokation, das in den Konformationen A (in Domäne II) (C) und B (in Domäne I) (E) vorliegen kann. Durch diese Flexibilität des Intermediates entsteht entweder das Produkt (S)-β-Bisabolen in Domäne I (F) oder Sesquithujen in Domäne II (D). Modifiziert nach [7]. Die multiplen Produkte der Terpensynthase TPS4 aus Mais werden durch zwei katalytische Domänen mit unterschiedlicher Aktivität im aktiven Zentrum des](https://www.mpg.de/451442/original-1293749870.jpg?t=eyJ3aWR0aCI6MzQxLCJmaWxlX2V4dGVuc2lvbiI6ImpwZyIsIm9ial9pZCI6NDUxNDQyfQ%3D%3D--93a3df31a99ef66f182400f2773036b7b82c4ef7)
![Die Produkte der Herbivor-induzierten Terpensynthase TPS10 aus Mais bilden ein Verteidigungssignal, das natürliche Feinde der Herbivoren anlockt. (A) Eine mit der Terpensynthase TPS10 transformierte Arabidopsispflanze und eine Kontrollpflanze wurden in einem sechsarmigen Olfaktometer auf ihre Attraktivität gegenüber der parasitischen Schlupfwespe Cotesia marginiventris getestet. (B) Naive Wespen ohne Erfahrung bei der Eiablage unterscheiden nicht zwischen der transgenen und der Kontrollpflanze. Wespen mit vorheriger Erfahrung hingegen assoziieren die Eiablage mit den TPS10-Terpenprodukten und bevorzugen für weitere Eiablagen die transgene Pflanze. Die mit ** markierten Gruppen zeigen signifikante Unterschiede in der Attraktivität (p>0.01). Modifiziert nach [8]. Die Produkte der Herbivor-induzierten Terpensynthase TPS10 aus Mais bilden ein Verteidigungssignal, das natürliche Feinde der Herbivoren anlockt. (A)](https://www.mpg.de/451498/original-1293749477.jpg?t=eyJ3aWR0aCI6MzQxLCJmaWxlX2V4dGVuc2lvbiI6ImpwZyIsIm9ial9pZCI6NDUxNDk4fQ%3D%3D--76321063418f5bdb005f549183dab801f658a512)
![Nach Befall mit Larven von Diabrotica virgifera geben Maispflanzen ein Terpensignal ab, das insektenpathogene Nematoden anlockt. (A) Adultform von Diabrotica virgifera. (B) Die Auftrennung von Terpenen durch Gaschromatographie zeigt eine starke Produktion des Terpens (E)-β-Caryophyllen in den Wurzeln der befallenen Pflanze. Modifiziert nach [4]. Foto: Marlin Rice, Iowa State Univ., USA. Nach Befall mit Larven von Diabrotica virgifera geben Maispflanzen ein Terpensignal ab, das insektenpathogene Nematoden anlockt. (A) Adultform von Dia](https://www.mpg.de/451554/original-1293749715.jpg?t=eyJ3aWR0aCI6MzQxLCJmaWxlX2V4dGVuc2lvbiI6ImpwZyIsIm9ial9pZCI6NDUxNTU0fQ%3D%3D--be81418edee276c8b53b0ee8eb3e6899c866cbf0)