Verteidigungsstrategien der Gemeinen Fichte bei Borkenkäferbefall
Forschungsbericht (importiert) 2012 - Max-Planck-Institut für chemische Ökologie
Einführung
Fichten zählen auf der Nordhalbkugel zu den wichtigsten forstwirtschaftlich genutzten Baumarten. In Mitteleuropa ist die Gemeine Fichte (Picea abies) der am meisten genutzte Baum. Da in Deutschland und auch weltweit etwa 25 Prozent aller Bäume zu dieser Art gehören, besitzt die Fichte aber nicht nur eine enorme wirtschaftliche, sondern auch eine herausragende ökologische und klimatische Bedeutung, und leistet einen entscheidenden Beitrag zur weltweiten CO2-Bilanz.
Fichten sind während ihres langen Lebens von bis zu 300 Jahren einer Vielzahl von abiotischen und biotischen Stressfaktoren ausgesetzt. Beispiele dafür sind Trockenheit und erhöhte Temperaturen oder auch der Befall durch Insekten wie den Borkenkäfer Ips typographus und den mit ihm stets assoziierten Blaufäulepilz Ceratocystis polonica. Meistens kann nicht nur von einem einzigen Stressfaktor ausgegangen werden, da sich die einzelnen abiotischen und die vielen biotischen Stressfaktoren auch gegenseitig beeinflussen können. Beispielsweise bedingt die Trockenheit eines Baumes eine geringere Fitness und hat eine erhöhte Anfälligkeit gegen Insekten- bzw. den mit ihm in Verbindung stehenden Pilzbefall zur Folge. Da Fichten innerhalb ihres gesamten Lebens ortsgebunden sind, müssen sie im Laufe der Evolution sehr effiziente Schutzmechanismen gegen diese Stressvielfalt entwickelt haben.
Borkenkäfer-Invasionen richten seit jeher großen ökonomischen wie auch ökologischen Schaden für die Fichte an. Dabei wird der einzelne Baum zuerst von Pionierkäfern befallen, die den Geschmack testen und dann baumeigene Inhaltsstoffe, in diesem Fall α-Pinen, in das käferspezifische Pheromon Verbenol umwandeln, um damit Hunderte und Tausende von anderen Käfern anzulocken. Diese verursachen dann die bekannten Käferkalamitäten, denen jedes Jahr Tausende von Kubikmetern Fichtenwald zum Opfer fallen, wie beispielsweise im Nationalpark Böhmerwald im Jahre 2007 geschehen. Allerdings wurde dort in den Jahren darauf auch beobachtet, dass bei einem Borkenkäferbefall nicht immer alle Bäume in gleichem Umfang betroffen sind. Selbst fünf Jahre nach einer Borkenkäferkalamität gibt es immer noch einige wenige, die, obwohl sie anfangs rein äußerlich nicht von den anderen befallenen Bäumen zu unterscheiden waren, noch resistent gegenüber dem Borkenkäfer und dem mit ihm assoziierten Blaufäulepilz sind (Abb. 1). Es ist daher davon auszugehen, dass baumspezifische Sekundärmetabolite, die im Gegensatz zu den Primärmetaboliten nicht an allen lebensnotwendigen Stoffwechselvorgängen beteiligt sind und eher im Rahmen von Schutzfunktionen gebildet werden, für das Weiterleben des Baumes verantwortlich sind.

Abb. 1: Nationalpark Böhmerwald, aufgenommen im Mai 2012 nach einer Borkenkäferinvasion im Jahr 2007. Zwischen abgestorbenen, ehemals befallenen Fichten finden sich immer noch einzelne resistente Bäume.
Welche Sekundärmetabolite könnten das sein? Bekannt ist, dass der Baum neben seinen ständig exprimierten Harzkanälen in der Borke nach Borkenkäfer- bzw. Pilzbefall einen Ring an neuen, kleineren Harzkanälen im Kambium (das ist im Borkengewebe die Wachstumsschicht, in der sich die Zellen teilen) bilden kann, also direkt an der vermeintlichen Fraßstelle des Borkenkäfers. Diese neu entstandenen Harzkanäle und Harze erhöhen einerseits bereits aufgrund ihrer Klebrigkeit die Resistenz, andererseits unterscheidet sich auch deren chemische Zusammensetzung von den im Baum vor Befall gebildeten Harzen. Chemisch setzt sich Baumharz aus Mono- und Diterpenen in einem unterschiedlichen Polymerisierungsgrad zusammen. Es liegt also nahe anzunehmen, dass Enzyme, die eine Schlüsselfunktion beim Befüllen ausschließlich dieser neuen Harzkanäle besitzen, auch eine spezielle Funktion bei der Resistenzreaktion des Baumes innehaben. Allerdings ist auch bekannt, dass die Bildung dieser Harzkanäle erst etwa drei Wochen nach Befallsbeginn vollständig ist und demzufolge auch die Schutzfunktion für den Baum erst zu diesem späten Zeitpunkt beginnen würde – was allerdings, ökologisch gesehen, zu spät wäre. Daher ist anzunehmen, dass es zusätzliche, andere Sekundärmetabolite geben muss, die die Schutzfunktion des Baumes unmittelbar nach dem Befall gewährleisten. Diese Verbindungen könnten bestimmte Polyphenole sein, die normalerweise nicht vorkommen und erst nach Induktion durch Käfer/Pilzbefall in das Kambium innerhalb sogenannter Steinzellen eingelagert werden.
Warum entwickelte der Käfer/Pilz-resistente Baum offensichtlich diese zwei verschiedenen, aufeinander abgestimmten Verteidigungsstrategien? Einerseits gewährleisten zwei Verteidigungssysteme per se immer einen besseren Schutz als eines. Andererseits bieten polyphenolische Verbindungen zwar einen effizienten Schutz, der aber wahrscheinlich entweder nur kurzfristig wirksam oder aber wegen eines zu hohen Umsatzes an sekundären Stoffwechselprodukten für den Baum langfristig zu kostspielig ist. Demgegenüber scheint das Terpene enthaltende Baumharz der neu entwickelten Harzkanäle einen wesentlich „kostengünstigeren“ Langzeitschutz zu gewährleisten [1].
Molekulare Mechanismen der induzierten Abwehr
Mono- und Diterpene
Terpene stellen mit rund 50000 Verbindungen die mit am häufigsten vorkommenden Sekundärmetabolite in Pflanzen dar. Schlüsselenzyme der Terpenbiosynthese sind die Isoprenyldiphosphat-Synthasen (IDS), die die Verknüpfungsreaktion zwischen Isopentenyldiphosphat und Dimethylallyldiphosphat katalysieren (Abb. 2). Da die Gesamtheit aller Terpene stets über die Zwischenstufen Geranyl-, Farnesyl- und Geranylgeranyl-Diphosphat gebildet wird, die als Reaktionsprodukt der IDS fungieren und gleichzeitig das C10-, C15- und C20-Kohlenstoffgerüst aller Mono-, Sesqui- und Diterpene bilden, befinden diese Enzyme sich an einem geschwindigkeitsbestimmenden und somit entscheidenden Verzweigungspunkt innerhalb der Terpenbiosynthese. In der Arbeitsgruppe wurden bereits mehrere IDS-kodierende Gene aus der Fichte isoliert und charakterisiert.
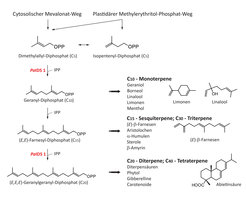
Abb. 2: Schema der Terpenbiosynthese. Aus den Vorstufen Dimethylallyl-Diphosphat und Isopentenyl-Diphosphat (IPP) werden die C10-, C15- und C20-Vorstufen aller Terpene, also Geranyl-, Farnesyl- und Geranylgeranyl-Diphosphat, durch Isoprenyldiphosphat-Synthasen (IDS) katalysiert. PaIDS 1 katalysiert in der Fichte (Picea abies) die parallele Synthese von Geranyl- und Geranylgeranyl-Diphosphat, die als Vorläufermoleküle aller Mono- und Diterpene im Baumharz fungieren.
Dabei stellte sich heraus, dass speziell die PaIDS1, die eine bifunktionelle Geranyl-/ Geranylgeranyl-Diphosphat-Synthase kodiert, genau diejenigen Vorläufermoleküle der Mono- und Diterpene liefert, aus denen das Baumharz zusammengesetzt ist. Sie übt wahrscheinlich eine Schlüsselfunktion innerhalb der induzierten Abwehr des Baumes aus. Das Enzym ist nur in denjenigen Zellen lokalisiert, die die neu entstandenen Harzkanäle begrenzen. Es konnte zudem ein erhöhter Expressionsgrad des jeweiligen Gens in den mit Borkenkäfer/Pilz befallenen Bäumen gefunden werden, der mit einer Resistenz des Baumes korreliert. So besitzt beispielsweise ein komplett resistenter Baum im Kambium eine höhere Expression der PaIDS1 als ein nur teilweise resistenter, dieser aber wiederum mehr als ein empfindlicher Baum. Daher ist es wahrscheinlich in Zukunft möglich, lediglich anhand des Expressionsgrades dieses Gens im Vorfeld eine Resistenz des jeweiligen Baumes gegenüber dem Borkenkäfer/Pilzbefall vorauszusagen – was allerdings noch weitere Untersuchungen erfordert, die sowohl an transgenen, PaIDS1-überexprimierenden Bäumen als auch an PaIDS1-reprimierten Fichten durchgeführt werden [2, 3].
Polyphenolische Verbindungen
Steinzellen, die zusätzlich zu den neuen Harzkanälen im Kambium der Fichte nach Borkenkäfer/Pilzbefall gebildet werden, enthalten polyphenolische Verbindungen wie Stilbenglukoside oder Proanthocyanidine. Im Gegensatz zu den terpenoiden ist die Biosynthese dieser phenolischen Verbindungen allerdings bisher noch weitgehend unerforscht.
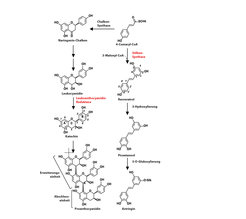
Um die Biosynthese der Stilbenglukoside näher zu untersuchen, wurden in der Arbeitsgruppe zwei Stilben-Synthase-Gene aus der Fichte, PaSTS1 und PaSTS2, identifiziert, welche die Kondensationsreaktion von p-Cumaryl-CoA und drei Molekülen Malonyl-CoA katalysieren und zur Bildung des Tetrahydroxystilbens Resveratrol führen. Demgegenüber wurden aber in transgener, PaSTS1-überexprimierender Fichte höhere Mengen an Astringin gefunden, was zu der Annahme führt, dass der erste Schritt der Stilbenbiosynthese in der Fichte die Bildung von Resveratrol ist, das später dann durch Hydroxylierung, O-Methylierung oder O-Glukosilierung in das in der Fichtenborke am meisten vorkommenden Stilbenglukosid Astringin umgewandelt wird (Abb. 3).
Um die Biosynthese der Proanthocyanidine in der Fichte näher zu charakterisieren, wurden drei Leukoanthocyanidin-Reduktasen (LAR) isoliert, die für die Biosynthese der Proanthocyanidin-Monomere verantwortlich sind. Auch hier konnte die Funktionalität sowohl durch In-vitro- Charakterisierung als auch durch Überexpression in transgenen Fichten gezeigt werden. Neu etablierte chemische Analysen zur Stereochemie der monomeren, dimeren und polymeren Proanthocyanidine zeigten, dass Monomere aus der Fichtenborke ausschließlich in der 2,3-trans-(+)-Form, Polymere aber dagegen hauptsächlich in der 2,3-cis-(-)-Form vorkommen (Abb. 3).
Die Regulation der Stilbenglukosid- und Proanthocyanidingehalte nach Pilzbefall wurde im Labor nach Inokulation mit C. polonica und anschließender Analyse der Borke in unterschiedlichen Befallsgraden genau untersucht. Dabei stellten die Wissenschaftler fest, dass die Transkriptmenge der PaSTS und der PaLAR ebenso wie der Gehalt an Stilbenglukosiden sowie mono- und polymeren Proanthocyanidinen während der Pilzinfektion signifikant erhöht war. In-vitro-Studien zeigten zudem ein geringeres Wachstum des Pilzes in Gegenwart der vom Baum gebildeten Stilbenglukoside und Proanthocyanidine, was auf die antifungale Wirkung dieser Substanzen schließen lässt. Allerdings erhöhten sich die Mengen der Stilbenglukoside im infizierten Borkengewebe nur während der ersten Tage nach Infektion und nahmen wider Erwarten danach wieder ab. Dieser Abfall konnte allerdings durch weitere Versuche erklärt werden, die zeigten, dass der Pilz dazu in der Lage ist, die vom Baum gebildeten Stilbenglukoside enzymatisch in Stilben-Dimere, Stilben-Laktone oder Piceatannol umzuwandeln. Die Umwandlung von Stilbenenglukosiden und Proanthocyanidinen durch den Pilz kann daher als eine mögliche Form der Entgiftung von pflanzlichen Sekundärmetaboliten angesehen werden [4, 5].


