Die Oberflächenchemie von Pflanzen und Insekten sichtbar machen
Forschungsbericht (importiert) 2014 - Max-Planck-Institut für chemische Ökologie
Die bildgebende Massenspektrometrie mit MALDI (Matrix-unterstützte Laser-Desorption/Ionisation) kann Oberflächenchemie sichtbar machen. Sie ermöglicht es, Senfölglycoside auf Pflanzenblättern zu lokalisieren, was Hinweise auf das Eiablageverhalten weiblicher Motten liefert. Auch die räumliche Verteilung fettsäureabgeleiteter Botenstoffe auf der Außenhaut von Fruchtfliegen konnte nachgewiesen und mit den Funktionen abgeglichen werden. Das Verfahren kann auch dazu dienen, weitere Stoffklassen auf Oberflächen zu untersuchen und so die chemische Kommunikation zwischen Organismen zu verstehen.
Einführung
Die Oberflächen aller Lebewesen, wie beispielsweise die Blattoberflächen von Pflanzen oder die Panzer von Insektenkörpern, spielen eine wichtige Rolle bei der Abwehr von verschiedenen Stressfaktoren, biotischen wie abiotischen. Über die Oberflächen wird die Durchlässigkeit von Wasser und Gasen reguliert, sie begrenzen den Verlust oder die unkontrollierte Aufnahme von löslichen Substanzen, bieten mechanische Stabilität, schirmen vor UV-Strahlen ab und schützen vor Fraßfeinden und Krankheitserregern. Um alle diese Funktionen genauer unter die Lupe zu nehmen und zu studieren, ist es wichtig zu wissen, welche chemischen Verbindungen sich auf den Oberflächen befinden und welche in tiefer gelegenen Zellschichten auftreten. Zum Beispiel können Abwehrstoffe bereits auf pflanzlichen Oberflächen gegen Fraßfeinde wirken – bevor diese überhaupt zugebissen haben. Auf der Außenhaut von Insekten wiederum befinden sich Lipide, die in die chemische Kommunikation involviert sind. Sie bestehen in erster Linie aus Wachsestern und anderen Kohlenwasserstoffen; Aldehyde, Ketone, Alkohole, Ester oder Säuren sind ebenfalls anzutreffen [1].
Trotz jahrelanger Forschung war es schwierig, ein Verfahren für den eindeutigen Nachweis einzelner chemischer Verbindungen auf Oberflächen zu entwickeln. Im Unterschied dazu konnten Substanzen, die in tieferen Zellschichten lagern, leichter nachgewiesen werden. „Oberflächenchemie“ wurde und wird bis heute mithilfe einfachster Methoden betrieben, zum Beispiel durch das Eintauchen von biologischen Proben in verschiedene Lösungsmittel oder durch das Abziehen der Cuticula, also der Blattoberfläche, mit Gummiarabikum oder mit Pinzetten. Die Ergebnisse aus solchen Analysen sind nicht selten widersprüchlich, insbesondere weil durch derartige invasive Methoden das Oberflächenmaterial nicht von weiteren Zellschichten abgrenzbar ist.
Die bildgebende Massenspektrometrie mit MALDI, auch: Matrix-unterstützte Laser-Desorption/Ionisation, stellt eine praktikable Alternative da. Sie wurde bereits erfolgreich angewandt, indem die Verteilung kleinster Moleküle bei höchster Empfindlichkeit in biologischen Proben bestimmt werden konnte [2; 3]. Da die Ionisierung unter engem Kontakt mit dem Matrix-Molekül möglich ist und die Matrix sich außerdem naturgemäß nach dem Auftragen ausschließlich auf der Oberfläche befindet, wird sichergestellt, dass nur Oberflächensubstanzen analysiert werden [4; 5].
Mithilfe der MALDI-Bildgebung wurden Messungen bislang nur qualitativ durchgeführt. Jedoch ist eine akkurate Quantifizierung der molekularen Bestandteile grundlegend für exakte Oberflächenanalysen, nicht zuletzt, um die Zusammensetzung verschiedener Oberflächen miteinander und mit dem jeweils darunterliegenden Gewebe vergleichen zu können. Auch ein Nachweis, dass die identifizierten und quantifizierten Substanzen biologisch relevant sein könnten, ist unabdingbar für die Beantwortung chemisch-ökologischer Fragen.
Arabidopsis und Senfölglycoside
Die Oberflächenlokalisierung pflanzlicher Senfölglycoside ist viele Jahre lang ein kontrovers diskutiertes Thema gewesen. Diese schwefelhaltigen Stoffwechselprodukte, die fast ausschließlich in Pflanzenfamilien aus der Ordnung der Kreuzblütlerartigen (Brassicales) zu finden sind, sind gut charakterisierte und natürliche pflanzliche Abwehrsubstanzen gegen Insektenfraß. Sie werden nach Befall durch eine Glucohydrolase-vermittelte Spaltung aktiviert [6].
Vor einigen Jahren wandten die Wissenschaftler erstmals massenspektrometrische Bildgebung mit MALDI an, um die räumliche Verteilung von Senfölglycosiden im Gewebe von Blättern der Ackerschmalwand Arabidopsis thaliana zu bestimmen [7]. Inzwischen konnte das Verfahren so modifiziert werden, dass nunmehr ausschließlich diejenigen Senfölglycoside nachweisbar sind, die sich auf der Blattoberfläche befinden – indem die Matrix durch Sublimation aufgetragen wird, was bedeutend weniger invasiv ist als das Auftragen flüssiger Substanzen. Diese Methode wurde durch die Anwendung zweier zusätzlicher Oberflächenanalysemethoden validiert, was eine Quantifizierung und deren Kalibrierung durch das Auftragen bekannter Mengen an Senfölglycosiden ermöglicht. Es stellte sich heraus, dass die Blattoberfläche von A. thaliana ungefähr 15 nmol Senfölglycoside pro Blatt enthielt, davon befanden sich etwa 50 pmol pro mm2 auf abaxialen (Blattunterseiten), jedoch 15-20 mal weniger auf adaxialen (Blattoberseiten) Oberflächen (Abb. 1, A und B).
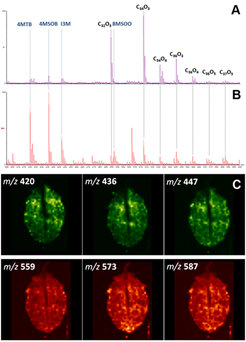
Abb. 1: Blattanalysen der Ackerschmalwand (Arabidopsis thaliana): MALDI-TOF/MS-Spektren (gemessen im Negativmodus) von Blattoberflächen, kombiniert mit massenspektrometrischen (MALDI-TOF) Bildern. (A) Adaxiale Oberfläche (Blattoberseite). (B) Abaxiale Oberfläche (Blattunterseite). Die Spektren wurden aufgezeichnet, nachdem die Matrix 9-Aminoacridin auf vier Wochen alte Blätter aufgetragen worden war. Die Konzentration der Senfölglycoside (4MTB, 4-Methylthiobutyl-Glucosinolat; 4MSOB, 4-Methylsulfinylbutyl-Glucosinolat; I3M, Indol-3-ylmethyl-Glucosinolat; 8MSOO, 8-Methylsulfinyloctyl-Glucosinolat) ist auf der Blattunterseite wesentlich höher als auf der Blattoberseite und ihre Zusammensetzung unterscheidet sich deutlich von derjenigen, die im gesamten Blatt festgestellt wurde [7]. (C) Massenspektrometrische (MALDI-TOF) Bilder ausgewählter Blattoberflächen. Die obere Reihe zeigt in Falschfarbendarstellung das Vorhandensein der Ionen m/z 420 (entspricht 4MTB, 4-Methylthiobutyl-Glucosinolat), 436 (entspricht 4MSOB, 4-Methylsulfinylbutyl-Glucosinolat) und 447 (entspricht I3M, indol-3-ylmethyl-Glucosinolat). Die Abkürzung m⁄z wird in der Massenspektrometrie als dimensionslose Größe verwendet, in der die Massenzahl eines Ions durch ihre Ladungszahl geteilt wird. Dabei ist m allerdings nicht die ionische Masse und z ist auch nicht ein Vielfaches der Elementarladung. Die untere Reihe zeigt die Ionen m/z 559, 573, 587, die bestimmten Hydroxyfettsäuren des Cutins entsprechen. Deutlich wird, dass die Senfölglycoside auf Blattoberflächen keinerlei Lokaliationsmuster aufweisen; sie sind mehr oder weniger gleichmäßig verteilt. Dies unterscheidet sich vom Blattgewebe, wo sehr hohe Konzentrationen an den Rändern und an der Hauptader zu finden sind, während andere Bereiche nahezu frei von Glucosinolaten sind [7].
Zu den Hauptverbindungen, die dabei entdeckt wurden, gehören 4-Methylsulfinylbutyl-Glucosinolat, Indol-3-ylmethyl-Glucosinolat sowie 8-Methylsulfinyloctyl-Glucosinolat, die zu den häufigsten Senfölglycosiden zählen und auch im Blattgewebe gefunden werden. Allerdings konnten von der zweithäufigsten Verbindung auf der Blattoberfläche, 4-Methylthiobutyl-Glucosinolat, nur Spuren im Blattinneren nachgewiesen werden. Die Verteilung auf der Blattoberfläche war gleichmäßiger als beim Blattgewebe, wo die Senfölglycoside in höheren Konzentrationen an der Hauptader und am äußeren Rand vorgefunden wurden (Abb. 1, C). Ungefähr 1-5 % der gesamten Blatt-Senfölglycoside waren an der Oberfläche anzutreffen. Diese Ergebnisse wurden durch zwei weitere massenspektrometrische Verfahren bestätigt: Laser-Ablations-Electrospray-Ionisierung (LAESI) und Flüssig-Extraktion-Oberflächen-Analyse (Liquid Extraction Surface Analysis, LESA).
Die geringen Senfölglycosid-Konzentrationen auf den Oberflächen der Blätter reichen offensichtlich immer noch aus, um Weibchen der Lepidoptera-Arten Plutella xylostella (Kohlmotte) und Pieris rapae (Kohlweißling) anzulocken, die auf Kreuzblütler als Nahrung spezialisiert sind. Beide wurden erfolgreich zur Eiablage stimuliert – sehr zum Nachteil der Pflanze, jedoch zum großen Vorteil der aus den Eiern schlüpfenden Schädlinge [8].
Semiochemikalien und Fruchtfliegen
Die räumliche Verteilung neutraler Lipide und Semiochemikalien (Botenstoffe) auf der Oberfläche von sechs Tage alten, nach Geschlechtern getrennt aufgezogenen Fruchtfliegen der Art Drosophila melanogaster wurde ebenfalls visualisiert. Angewendet wurden sowohl Matrix unterstützte Desorption/Ionisation-Massenspektrometrie (MALDI-TOF) als auch Laser-unterstütztes Desorption/Ionisations (LDI-TOF)-Imaging (MSI, [9]). Für den MALDI-TOF-Modus wurden die Fliegen fixiert und mit einer Lithium-2,5-Dihydroxybenzoat (LiDHB)-Matrix besprüht. Bis zu 100 Sprayzyklen waren notwendig, um ein homogenes Auftragen der kristallinen Matrix auf Insektenkutikula zu garantieren. Neutrale Lipide und andere nicht-polare Verbindungen konnten nachgewiesen werden, inklusive des männlichen Anti-Lockstoffs 11-cis-Vaccenyl-Acetat, für das sich die erwartete Verteilung mit hohen Konzentrationen auf der Spitze des männlichen Abdomens bestätigte: Von dort aus verteilen die Männchen nach der Begattung den Antilockstoff auf das Abdomen der Weibchen, um dieses für weitere Männchen unattraktiv zu machen (Abb. 2).
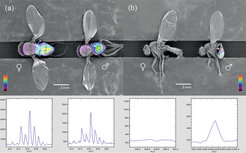
Die mit dieser Methode ermittelten Massenzahlen schwanken um 0,2 bis zu 0,3 Dalton. Um diese Ungenauigkeit zu eliminieren, wird eine von den Wissenschaftlern in Jena entwickelte Software genutzt, die eine Rekalibrierung der Massenzahlen erlaubt und gleichzeitig dazu beiträgt, Massensignale mit niedriger Intensität zu detektieren. Kürzlich konnte die Signalintensität zusätzlich verbessert werden, indem die Insekten mit Celite®-Puder eingestäubt wurden. Die Celite-Partikel stellen Bio-Nano-Strukturen dar und initiieren die für die Massenspektometrie notwendige Ionisierung der zu untersuchenden Substanzen – genauso wie die eingangs erwähnte Matrix-Sublimation, die bei den Blattoberflächen angewendet wurde [10].
Schlussfolgerungen
Die hier vorgestellten bildgebenden, auf Massenspektrometrie basierenden Methoden zur Visualisierung von Oberflächenchemie sind vielversprechende Werkzeuge, mit deren Hilfe die chemische Kommunikation zwischen Organismen besser untersucht werden kann. Bei quantitativer Anwendung liefern sie akkurate Angaben der auf den Oberflächen jeweils anzutreffenden Verbindungen, deren Mengen und deren Verteilung. Kontaminationen mit Verbindungen aus tieferen Zellschichten werden vermieden und nicht erfasst.
Dennoch: Bislang wurden alle Messungen unter Vakuum und an toten Gewebeproben durchgeführt. Der nächste Schritt ist, eine Massenspektrometrie-Imaging-Methode zu etablieren, die die Oberflächenchemie von lebenden Proben ermöglicht. 2014 wurde das Labor am MPI für chemische Ökologie durch ein neues Massenspektrometer erweitert, das für das Erreichen dieses Zieles bestens geeignet scheint. Neben der Optimierung der Messbedingungen und der Probenvorbereitung sind einige weitere Herausforderungen zu bewältigen; die parallele Anwendung von optischer oder Fluoreszenz-Mikroskopie mit MALDI-MSI ist eine davon. Zusätzlich muss, je nach Lebendprobe, deren Oberflächentopologie mit hoher Präzision bestimmt werden, besonders, wenn eine hohe laterale Auflösung benötigt wird. All diese Herausforderungen sollten schnell gelöst werden können, denn für das Projekt stellt die International Max Planck Research School fünf zusätzliche Doktorandenstipendien zur Verfügung.
Literaturhinweise
Hamilton R. J. (Editor), The Oily Press: Dundee, Scotland, 1-90 (1995)
Proteomics 11, 1840-1850 (2011)
Trends in Biotechnology 28, 425-434 (2010)
Journal of the American Society for Mass Spectrometry 18, 1646-1652 (2007)
Journal of the American Society for Mass Spectrometry 21, 220-231 (2010)
Annual Review of Plant Biology 57, 303-333 (2006)
The Plant Journal (2015)
DOI: 10.1111/tpj.12760
Rapid Communications in Mass Spectrometry 27, 109-116 (2013)
![Abb. 1: Blattanalysen der Ackerschmalwand (Arabidopsis thaliana): MALDI-TOF/MS-Spektren (gemessen im Negativmodus) von Blattoberflächen, kombiniert mit massenspektrometrischen (MALDI-TOF) Bildern. (A) Adaxiale Oberfläche (Blattoberseite). (B) Abaxiale Oberfläche (Blattunterseite). Die Spektren wurden aufgezeichnet, nachdem die Matrix 9-Aminoacridin auf vier Wochen alte Blätter aufgetragen worden war. Die Konzentration der Senfölglycoside (4MTB, 4-Methylthiobutyl-Glucosinolat; 4MSOB, 4-Methylsulfinylbutyl-Glucosinolat; I3M, Indol-3-ylmethyl-Glucosinolat; 8MSOO, 8-Methylsulfinyloctyl-Glucosinolat) ist auf der Blattunterseite wesentlich höher als auf der Blattoberseite und ihre Zusammensetzung unterscheidet sich deutlich von derjenigen, die im gesamten Blatt festgestellt wurde [7]. (C) Massenspektrometrische (MALDI-TOF) Bilder ausgewählter Blattoberflächen. Die obere Reihe zeigt in Falschfarbendarstellung das Vorhandensein der Ionen m/z 420 (entspricht 4MTB, 4-Methylthiobutyl-Glucosinolat), 436 (entspricht 4MSOB, 4-Methylsulfinylbutyl-Glucosinolat) und 447 (entspricht I3M, indol-3-ylmethyl-Glucosinolat). Die Abkürzung m⁄z wird in der Massenspektrometrie als dimensionslose Größe verwendet, in der die Massenzahl eines Ions durch ihre Ladungszahl geteilt wird. Dabei ist m allerdings nicht die ionische Masse und z ist auch nicht ein Vielfaches der Elementarladung. Die untere Reihe zeigt die Ionen m/z 559, 573, 587, die bestimmten Hydroxyfettsäuren des Cutins entsprechen. Deutlich wird, dass die Senfölglycoside auf Blattoberflächen keinerlei Lokaliationsmuster aufweisen; sie sind mehr oder weniger gleichmäßig verteilt. Dies unterscheidet sich vom Blattgewebe, wo sehr hohe Konzentrationen an den Rändern und an der Hauptader zu finden sind, während andere Bereiche nahezu frei von Glucosinolaten sind [7]. Abb. 1: Blattanalysen der Ackerschmalwand (Arabidopsis thaliana): MALDI-TOF/MS-Spektren (gemessen im Negativmodus) von Blattoberflächen, kombiniert mi](https://www.mpg.de/11613761/original-1508157569.jpg?t=eyJ3aWR0aCI6MzQxLCJmaWxlX2V4dGVuc2lvbiI6ImpwZyIsIm9ial9pZCI6MTE2MTM3NjF9--9003ae584812930bd591836e3e1eb17abc61a80d)
![Abb. 2: Rasterelektronen-mikroskopische Aufnahmen von zwei Fruchtfliegenpaaren der Art Drosophila melanogaster. Die Fliegen waren sechs Tage alt und jungfräulich. Die Aufnahmen wurden mit 2-D-Karten überlagert, die als Falschfarbendarstellung die Signalintensitäten der jeweiligen Analyte zeigen. (a) Neutrale Lipide (Triglyceride, TGs): m/z 810 bis 820; (b) Anti-Lockstoff 11-cis-Vaccenyl-Acetat, hier gemessen zusammen mit Kaliumionen ([M+K]+): m/z 349.4. Abb. 2: Rasterelektronen-mikroskopische Aufnahmen von zwei Fruchtfliegenpaaren der Art Drosophila melanogaster. Die Fliegen waren sechs Tage alt und j](https://www.mpg.de/11613769/original-1508157570.jpg?t=eyJ3aWR0aCI6MzQxLCJmaWxlX2V4dGVuc2lvbiI6ImpwZyIsIm9ial9pZCI6MTE2MTM3Njl9--bc69e425f3b5652d3705006e9501821c61b6bdd9)